In Vitro Evaluation of a New Combination of Three Antibiotic Paste Against Common Endodontic Pathogens
ارزیابی آزمایشگاهی ترکیبی جدید از سه خمیر آنتیبیوتیکی در برابر پاتوژنهای رایج ریشه
Prasanna Dahake1، Nilima Thosar2
1 دانشجوی دکتری، دانشکده علوم دندانپزشکی، گروه دندانپزشکی، دانشکده و بیمارستان دندانپزشکی شراد پاور، DMIMS (دانشگاه تلقی می شود) – ساوانگی (M)، واردا، ماهاراشترا، هند 2 PhD، MDS گروه دندانپزشکی و دندانپزشکی پیشگیری ، کالج و بیمارستان دندانپزشکی شراد پاوار، DMIMS (دانشگاه Dee) – ساوانگی (M)، واردا، ماهاراشترا، ایندیامد
خلاصه
زمینه و هدف:
حذف میکروارگانیسمهای بیماریزا از سیستم کانال ریشه کلید موفقیت درمان ریشه است. این مطالعه با هدف بررسی کارایی ضد باکتریایی سه عامل ضد باکتریایی و ترکیبی جدید در برابر پاتوژنهای منتخب ریشه انجام شد.
مواد و روشها:
در این مطالعه آزمایشگاهی، اثربخشی سه عامل آنتیباکتریایی مختلف به نامهای کلیندامایسین، مترونیدازول، داکسیسایکلین و ترکیب آنها (CMD) بر روی هفت سویه باکتریایی مرتبط با عفونتهای ریشه برای تعیین حداقل غلظت بازدارنده (MIC) و حداقل غلظت باکتری کش (MBC) مورد بررسی قرار گرفت.
محیط های انتخابی برای کشت کاندیدا آلبیکنس (C. albicans)، سودوموناس آئروژینوزا (P. aeruginosa)، اشریشیا کلی (E. coli)، انتروکوکوس فکالیس (E. faecalis)، استرپتوکوک موتانس (S. mutans)، باسیلوس سوبتیلیس (B. subtilis) subsp. spizizenii، و Actinomyces actinomycetemcomitans (A. actinomycetemcomitans). تمام آزمایشات در سه مرحله تکرار شد.
مقادیر MIC و MBC به صورت میانگین ± انحراف استاندارد گزارش شد. داده ها با استفاده از آزمون شاپیرو-ویلک، کروسکال-والیس و آزمون رتبه علامت دار ویلکاکسون مورد تجزیه و تحلیل قرار گرفت (05/0P<).
یافته ها:
مقایسه بین گروهی MIC برای کلیندامایسین در مقابل CMD (036/0=P)، مترونیدازول در مقابل CMD (016/0=P) و داکسی سایکلین در مقابل CMD (016/0=P) تفاوت معنی داری را نشان داد و تفاوت مشخص دیگری مشاهده نشد (05/0P>).
مقایسه بین گروهی MBC برای کلیندامایسین در مقابل CMD (036/0=p)، مترونیدازول در مقابل CMD (022/0=P) و داکسی سایکلین در مقابل CMD (016/0=p) تفاوت معنی داری را نشان داد. تفاوت قابل توجه دیگری مشاهده نشد (05/0P>).
نتیجه گیری:
CMD اثر ضد باکتریایی بالاتری نسبت به هر آنتی بیوتیک جداگانه نشان داد و می تواند به طور موثر در برابر پاتوژن های ریشه ذکر شده برای حذف قابل پیش بینی آنها در طول درمان ریشه مورد استفاده قرار گیرد.
مقدمه
باکتریهایی که به صورت مشترک در حفره دهان زندگی میکنند در شرایط عادی بیضرر هستند. اما ممکن است به دلیل بیان چند صفت حدت که بیماری زایی آنها را افزایش می دهد، در سلامتی مضر باشند.
یکی از روشهای بسیار عجیب وجود بیماریزایی توسط چنین میکروارگانیسمهایی، تشکیل بیوفیلم است. بیوفیلم های ایجاد شده توسط یک گونه از باکتری ها می توانند به عنوان زیستگاه برای گونه های دیگر عمل کنند. چنین پیوندهای همزیستی در بین سلول های باکتریایی شامل “پلاک” است که مسئول پوسیدگی دندان و بیماری های ریشه، پریودنتال و سایر بیماری های دهان است. بیماری های مرتبط با بیوفیلم عملا برای همه متخصصان در زمینه های پزشکی و دندانپزشکی چالش برانگیز است.
در طول درمان ریشه، پالپ دژنره شده/نکروزه از طریق آماده سازی بیومکانیکی سیستم کانال ریشه دبرید می شود. با این حال، باکتریهایی که در لایههای عمیقتر توبولهای عاجی قرار گرفتهاند، صرف نظر از اینکه از چه سیستم تغذیه ریشه استفاده میشود، جدا میشوند و درمان ریشه را زیر سؤال میبرند.
حذف چنین جمعیت میکروبی در طی مراحل درمانی از سیستم کانال ریشه و جلوگیری از تشکیل بیوفیلم خط اول درمان را تشکیل می دهد. بسیاری از عوامل شیمیایی به عنوان داروهای ریشه در طی چند دهه مورد استفاده قرار گرفته اند که شامل فنل ها، آلدئیدها، کورتیکواستروئیدها، هیدروکسید کلسیم، کلرهگزیدین و آنتی بیوتیک ها می شود. اما هنگامی که به تنهایی مورد استفاده قرار می گیرند، چنین عواملی طعمه میکروارگانیسم های مقاوم به چند دارو می شوند و فعالیت ضد میکروبی خود را در بین جلسات از دست می دهند و کارایی آنها برای از بین بردن باکتری ها در مناطق پیچیده تشریحی زیر سوال می رود. تکامل سویههای میکروبی مقاوم به چند دارو، محققان را در سراسر جهان وادار کرد تا ترکیبهای قابل اعتماد و بیولوژیکی ایمن از عوامل ضد میکروبی را برای هدف قرار دادن چنین میکروارگانیسمهایی ایجاد کنند.
با توجه به این مفهوم، مطالعه تجربی حاضر به منظور بررسی اثر ضد میکروبی سه عامل ضد میکروبی کلیندامایسین، مترونیدازول و داکسیسایکلین و ترکیب آنها (CMD) در برابر هفت سویه میکروبی ریشه مرتبط با عفونتهای ریشه طراحی شد. فرضیه آزمایش شده این بود که CMD اثر ضد باکتریایی بهتری نسبت به هر آنتی بیوتیک جداگانه برای از بین بردن پاتوژن های ریشه از خود نشان می دهد.
مواد و روش ها
مطالعه آزمایشگاهی حاضر پس از اخذ مجوز از کمیته اخلاقی سازمانی، نامه شماره، در بخش پدودنتیکس و گروه میکروبیولوژی انجام شد. DMIMS(DU)/IEC/2015-16/1744، به تاریخ: 31/12/2015. فعالیت ضد میکروبی عوامل ضد میکروبی مختلف در برابر سویههای استاندارد میکروارگانیسمها مورد آزمایش قرار گرفت.
مواد مورد استفاده برای میکروبیولوژیک
آزمایش:
عوامل آزمایشی مورد استفاده در مطالعه حاضر، عوامل ضد باکتری با درجه تحلیلی تجاری از جمله:
- کلیندامایسین HCL (Himedia Labs Pvt Ltd., Mumbai, India)
- داکسی سایکلین HCL (Himedia Labs Pvt Ltd., Mumbai, India)
- مترونیدازول (MP Biomedicals، LLC، فرانسه)
سویه های باکتریایی آزمایش شده:
The ATCC bacterial strains (Microbiologics, USA) were purchased from HiMedia Labs Pvt Ltd., Mumbai, India. Candida albicans (ATCC 10231) (C. albicans), Pseudomonas aeruginosa (ATCC 27853) (P. aeruginosa), Escherichia coli (ATCC 25922) (E. coli), Enterococcus faecalis (ATCC 35550) (E.faecalis), Streptococcus mutans (ATCC 25175) (S. mutans), Bacillus subtilis subsp. spizizenii (ATCC 6633) (B. subtilis), and Aggregatibacter actinomycetemcomitans (ATCC 29523) (A. actinomycetemcomitans)
در این مطالعه بر اساس همبستگی آنها با علائم بالینی عفونت های ریشه مورد استفاده قرار گرفتند.
تهیه تلقیح میکروبی:
تمام سلول های باکتریایی لیوفیلیزه شده برای تهیه سوسپانسیون باکتریایی اولیه با استفاده از 0.5 میلی لیتر براث انفوزیون قلب استریل مغز (BHI) به صورت غیرعفونی تحت یک کابین ایمنی بیولوژیکی جریان آرام (Bio-Clean Air Devices, Chennai, TN, India) در دمای اتاق احیا شدند. برای جلوگیری از آلودگی متقابل این سوسپانسیون با افزودن براث BHI استریل برای تهیه سوسپانسیون های باکتریایی ثانویه بیشتر گسترش یافت. در نهایت تمام مقادیر به استاندارد 0.5 مک فارلند شامل 107 واحد تشکیل کلنی (CFU) / میلی لیتر از سلول های باکتریایی کالیبره شدند.
تهیه محلول های موجود در عامل آنتی باکتریال:
تمام آنتیبیوتیکها طبق روشهای ذکر شده توسط Panpaliya و همکاران به محلولهای ذخیره تبدیل شدند. در حین تهیه محلول استوک، 2 میلی گرم از عامل ضد باکتری در 2 میلی لیتر آب مقطر استریل به طور همگن حل شد تا محلول موجود در غلظت 1000 میکروگرم بر میلی لیتر به دست آید. تمام محلولهای موجود در دمای 4 تا 8 درجه سانتیگراد در یک ظرف غیر شفاف درپوش پیچی نگهداری شدند تا از خشک شدن و اکسید شدن مواد فعال جلوگیری شود.
تعیین حداقل غلظت بازدارنده (MIC) عوامل ضد باکتری:
در این مطالعه، MIC تمام عوامل ضد باکتری به روش رقیق سازی جز به جز با استفاده از براث BHI تعیین شده اند. برای این منظور، 1 میلی لیتر از هر محلول موجود در یک لوله آزمایش استریل توزیع شد و به صورت متوالی از 1000 میکروگرم در میلی لیتر به 0.2 میکروگرم بر میلی لیتر رقیق شد و به ترتیب 13 لوله MIC و آخرین لوله MIC با براث BHI استریل بدون هیچ آزمایشی رقیق شد. عامل به عنوان کنترل منفی نگه داشته شد (در مجموع 14 لوله MIC برای هر عامل آزمایش ساخته شد). دستورالعمل های ارائه شده توسط CLSI برای تعیین MIC هر عامل دنبال شد. پنج میکرولیتر از هر مقدار باکتری به تمام لولههای MIC اضافه شد و روی دستگاه اختلاط گردابی (اسپینوین سانتریفیوژ، کره) مخلوط شد تا یک سوسپانسیون همگن بهدست آید. سپس تمام لوله های آزمایش در انکوباتور میکروبیولوژیکی تغییر فاز (Adarsh International, Haryana, India) در حالت های هوازی و بی هوازی در دمای 37 درجه سانتیگراد به مدت 24-48 ساعت انکوبه شدند تا رشد باکتری حاصل شود . مقادیر MIC همه عوامل آزمایش با بازرسی بصری تعیین شد و با استفاده از یک اسپکتروفتومتر (Orion™, Aqua-Mate 8000 UV-Vis, Thermo Fisher Scientific, US) در چگالی نوری (OD600) 0.6-0.7 تأیید شد. غلظت عوامل ضد باکتری که هیچ کدورتی را نشان نمی دهند (بدون شواهدی از رشد باکتری) به عنوان MIC عامل مربوطه برای آن میکروارگانیسم خاص در نظر گرفته شد.
تعیین حداقل غلظت باکتری کش (MBC) عوامل ضد باکتری:
برای تعیین MBC عوامل ضد میکروبی، 5 میکرولیتر از براث MIC انکوبه شده از هر لوله بر روی صفحات نوترینت آگار رگهدار شد و به مدت 48 ساعت در دمای 37 درجه سانتیگراد به صورت هوازی و بیهوازی انکوبه شد.
کمترین غلظت عامل ضد باکتری مهار کننده 99 درصد رشد باکتری از نظر ظاهر CFU به ترتیب به عنوان MBC عامل در برابر آن میکروارگانیسم خاص مشاهده شد.
تحلیل آماری:
تمام مراحل در سه مرحله (n=3) تکرار شد تا میانگین قرائت ها و به حداقل رساندن خطاها باشد. داده های به دست آمده از هر گونه باکتری و آزمایش آنتی باکتریال با استفاده از آمار توصیفی IBM SPSS برای ویندوز، نسخه 20.0 (IBM Corp., Armonk, N.Y., USA) مورد تجزیه و تحلیل آماری قرار گرفت. MIC و MBC هر عامل ضد باکتری در برابر هر میکروارگانیسم به صورت میانگین ± انحراف معیار و دامنه محاسبه شد. از آزمون Shapiro-Wilk برای ارزیابی نرمال بودن داده های به دست آمده در طول تجزیه و تحلیل آماری استفاده شد. MIC و MBC هر دو با استفاده از آزمون Kruskal-Wallis برای مقایسه های بین گروهی مورد تجزیه و تحلیل قرار گرفتند، در حالی که مقایسه های زوجی درون گروهی با استفاده از آزمون رتبه بندی علامت دار Wilcoxon انجام شد. سطح اطمینان 95 درصد تعیین شد (05/0P<).
نتایج
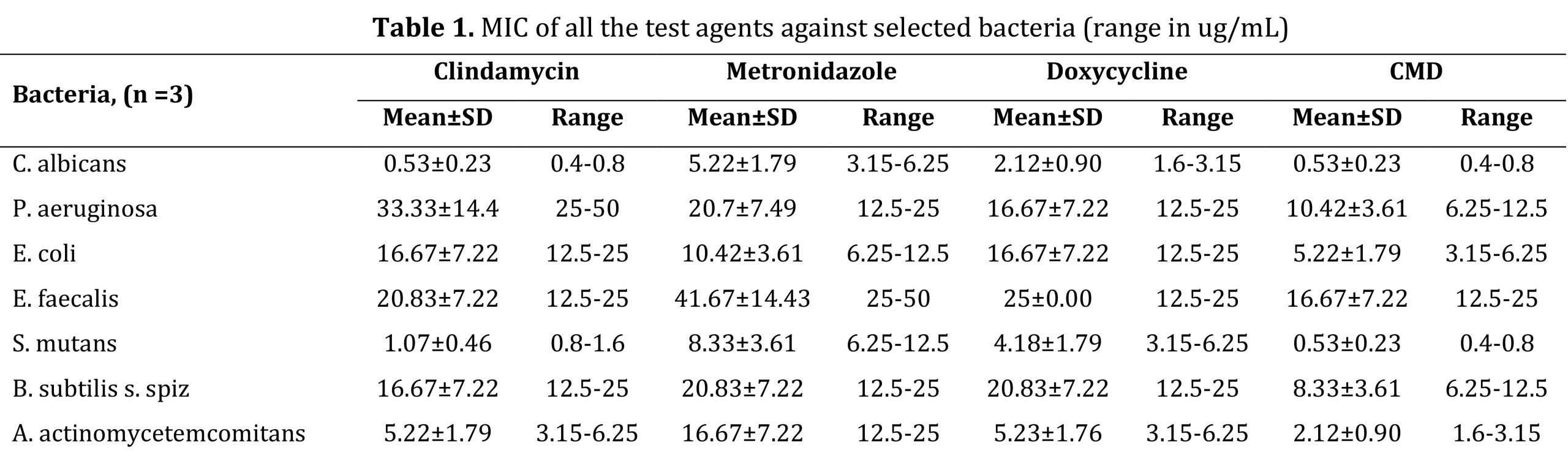
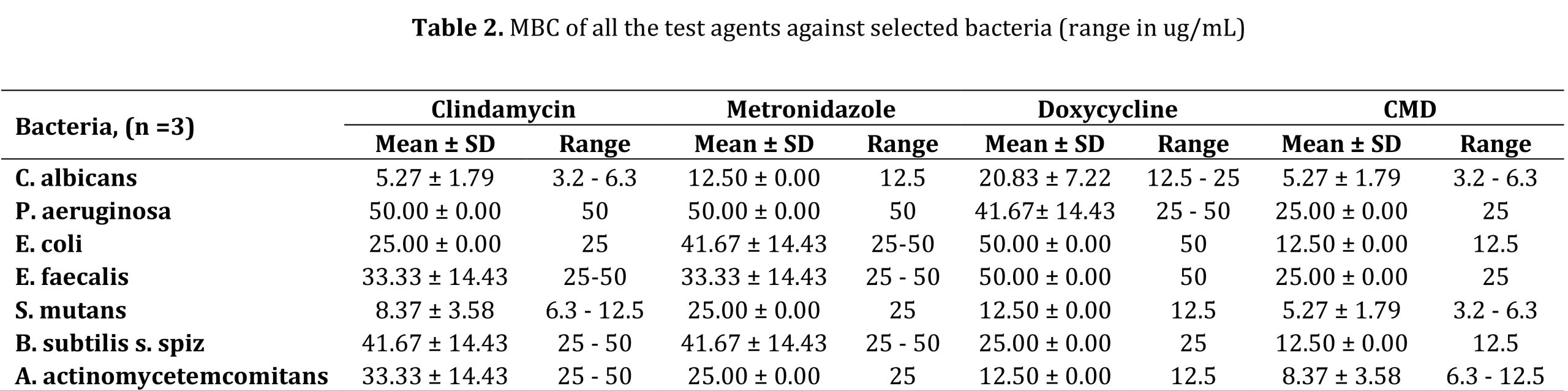
MIC و MBC همه عوامل آزمایش به ترتیب در جداول 1 و 2 خلاصه شده است. در میان تمام باکتریهای آزمایششده، C. albicans و S. mutans در برابر همه عوامل تست، بهویژه به CMD حساس بودند. در حالی که P. aeruginosa و E. faecalis نسبت به عوامل فردی مانند کلیندامایسین، مترونیدازول و داکسی سایکلین حساسیت کمتری داشتند، اما حساسیت خوبی به CMD داشتند.
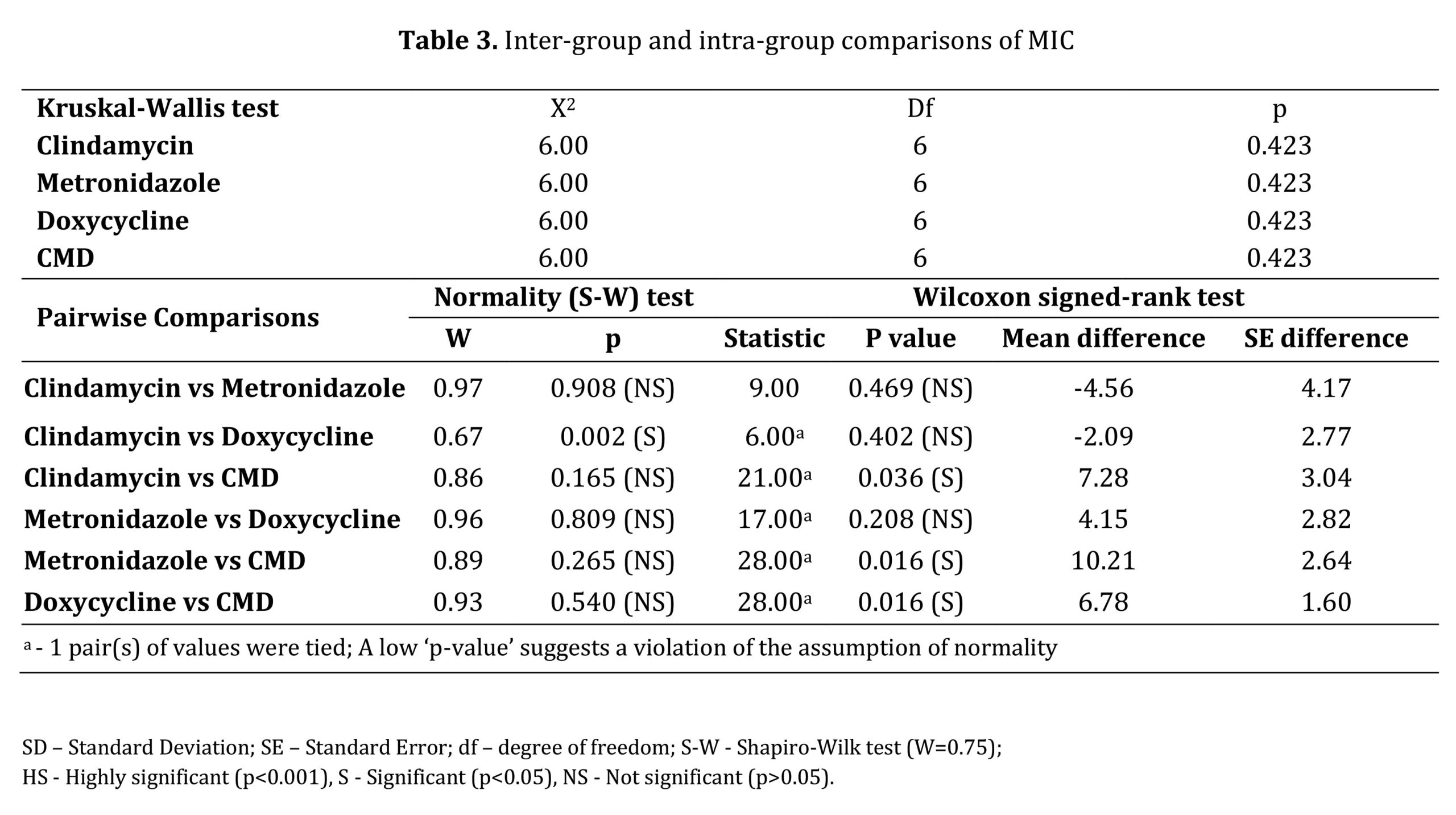
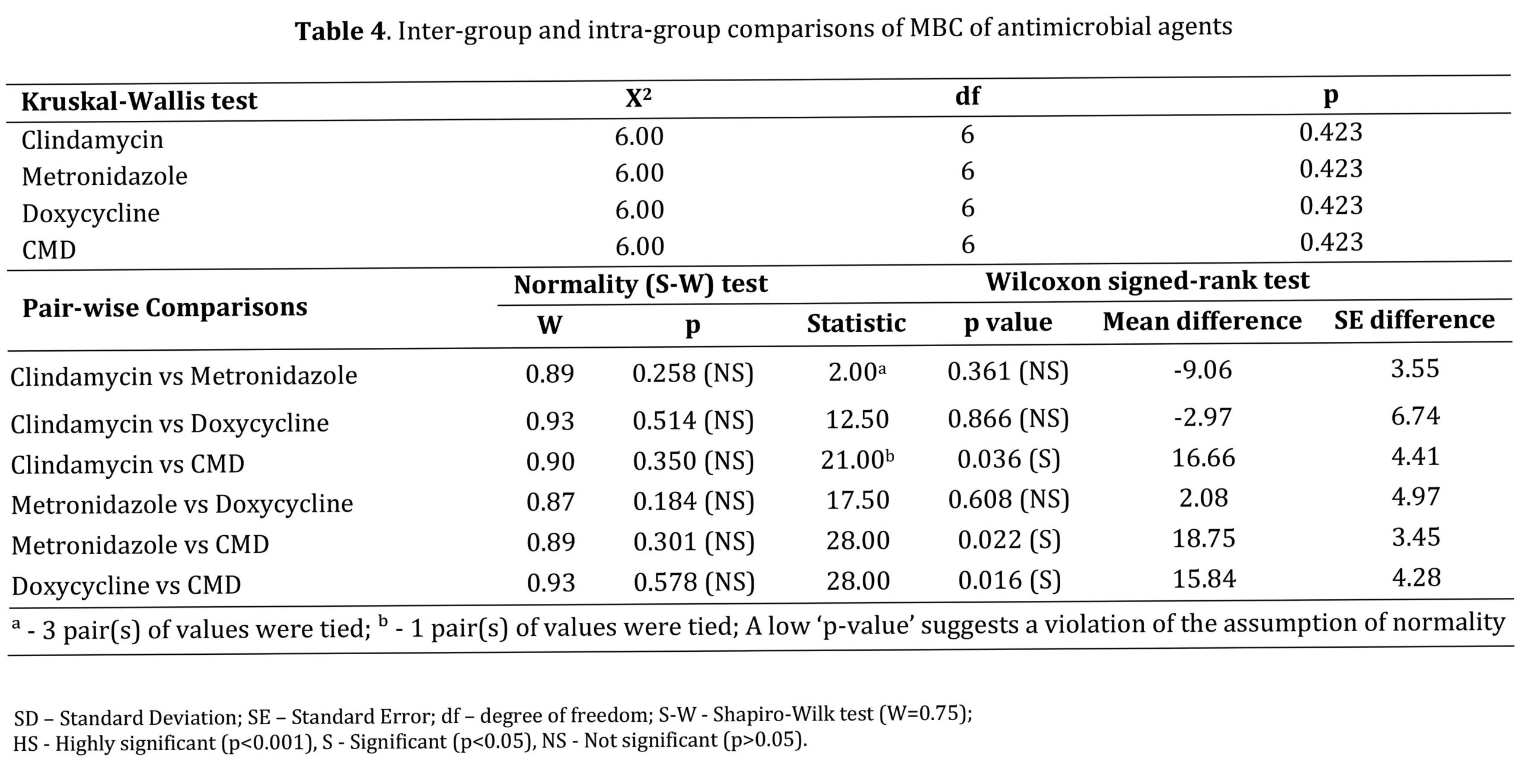
مقایسه بین گروهی همه عوامل آزمایش از نظر MIC و MBC با استفاده از آزمون کروسکال-والیس تفاوت معنی داری را نشان نداد (05/0P>) (به ترتیب جداول 3 و 4).
آزمون Shapiro-Wilk توزیع نرمال داده ها (05/0>P) را برای MIC و MBC نشان داد و تفاوت معنی داری نداشت (05/0P>)، به جز مقایسه درون گروهی کلیندامایسین در مقابل مقایسه درون گروهی کلیندامایسین در مقابل داکسی سایکلین. (P<0.05)( جدول 3).
تجزیه و تحلیل MIC از طریق مقایسههای درون گروهی دوتایی کلیندامایسین در مقابل CMD (036/0=P)، مترونیدازول در مقابل CMD (016/0=P) و داکسیسایکلین در مقابل CMD (016/0=P) تفاوتهای آماری معنیداری را نشان داد که نشاندهنده اثربخشی ضد باکتریایی بالاتر از CMD بود. عوامل فردی (P<0.05). با این حال، مقایسه عوامل فردی تفاوت معنی داری را نشان نداد (05/0 P>؛ جدول 3).
تجزیه و تحلیل MBC از طریق مقایسههای درون گروهی دوتایی کلیندامایسین در مقابل CMD (036/0=P)، مترونیدازول در مقابل CMD (022/0=P) و داکسیسایکلین در مقابل CMD (016/0=P) تفاوتهای آماری معنیداری را از نظر اثربخشی ضدباکتریایی نشان داد (P<P 0.05). هیچ تفاوت معناداری دیگری مشاهده نشد (05/0P>؛ جدول 4).
توضیحات ارزیابی آزمایشگاهی ترکیبی جدید از سه خمیر آنتیبیوتیکی در برابر پاتوژنهای رایج ریشه
پالپ دندان به دلیل داشتن عروق محدود و تخلیه لنفاوی ممکن است واکنشهای مختلفی به محرکهای بیولوژیکی، فیزیکی یا شیمیایی نشان دهد. گاهی اوقات، بافت پالپ دندانهای نابالغ (رشد نیافته) ممکن است برای مدت قابل توجهی دچار خونریزی شود، اما پالپ بالغ معمولاً برای مدت طولانی چنین شرایطی را تحمل نمیکند و حیات خود را از دست میدهد. پالپ تحلیلرفته/نکروزه و محصولات تخریب مختلف که از چنین بافتهای پالپی آزاد میشوند، نیدوس مطلوبی را برای کلونیسازی و رشد گونههای باکتریایی متعدد در اتاقک پالپ فراهم میکنند. تعداد کمی از سویه های باکتریایی، دارای پتانسیل ایجاد و حفظ یک محیط اسیدی یا قلیایی بالا هستند.
باکتری های ایجاد کننده عفونت ریشه از حفره دهان، دندان های پوسیدگی، آناکورزیس یا توبول های عاجی از پیش آلوده منشاء می گیرند که در مراحل اولیه درمان به اندازه کافی ضد عفونی نمی شوند. پاتوژن های ریشه که معمولاً از کانال ریشه شناسایی می شوند ممکن است شامل باکتری های هوازی مانند B. subtilis، Candida و Pseudomonas و همچنین باکتری های بی هوازی مانند Aggregatibacter، Enterococcus، Escherichia و Streptococcus باشند.
در عفونتهای ریشه، باکتری های بی هوازی گرم منفی، عوامل مسبب اصلی هستند که مسئول ویژگیهای بالینی پاتولوژیک مشخصه چند بیماری پری رادیکولار هستند. C. albicans در مواردی با نکروز پالپ، پریودنتیت مزمن آپیکال علامت دار و بدون علامت و درمان های ریشه ای ناموفق جدا شده است.
ایزوله کردن B.subtilis از موارد پریودنتیت ریشه مقاوم و آپیکال شناسایی شده است. این باکتریها با تشکیل بیوفیلم در کانالهای جانبی، شاخههای آپیکال و شکافهای بین مواد پرکننده و دیوارههای عاجی مرتبط هستند. B.subtilis قدرت بیماری خود را از طریق تشکیل بیوفیلم اگزوپلی ساکارید مستحکم اسپور و مش مانند نشان می دهد که اتصال و بقای آن در برابر عوامل ضد باکتری را تسهیل می کند.
E. faecalis به تعداد کم از کانال های درمان نشده بازیابی شده است. اما در طی درمان های ریشه، به دلیل آماده سازی بیومکانیکی ناکافی یا ضد عفونی، می تواند تکثیر شود و منجر به عفونت های پری آپیکال پایدار شود. E. faecalis طیف وسیعی از دما و pH را در حضور داروهای داخل کانالی حفظ می کند. این دارای پلی ساکارید کپسولی است که آن را در برابر بسیاری از عوامل ضد باکتری مقاوم می کند.
A.actinomycetemcomitans می تواند با ورود از کانال های جانبی و آپیکال به نواحی آپیکال و پری اپیکال باعث ایجاد ضایعات ریشه- پریودنتال شود. P. aeruginosa می تواند بیوفیلم را سنتز کند و آن را به درمان های ضد میکروبی مقاوم کند.
S. mutans که عمیقاً در پوسیدگی عاج وجود دارد، منبع اصلی عفونت ریشه است. همه این باکتری ها به عنوان یک موجودیت واحد ویژگی های متفاوتی از خود نشان می دهند. اما هنگامی که در محیط زیست میکروبی مختلط زندگی می کنند، در مجموع تداعی های پیچیده و رفتارهای متنوعی از خود نشان می دهند. این باکتری ها به دلیل وجود پروتئین های خارج سلولی، گلیکوپروتئین ها یا موکوپلی ساکاریدهای خارج سلولی که به چسبیدن و جلوگیری از رسیدن عوامل ضد میکروبی به سلول های باکتریایی کمک می کنند، تکثیر، رشد و بقای یکدیگر را افزایش می دهند.
عامل کلیدی برای موفقیت و طرح درمان در درمان ریشه، حذف همه پاتوژن های ریشه، همراه با عوامل جانبی آنها است. برای مدت طولانی، درمان انتخابی برای از بین بردن عوامل ایجاد کننده از سیستم کانال ریشه، تجویز عوامل ضد باکتری از طریق مسیرهای سیستمیک بوده است. با این حال، چنین روشی ممکن است برای درمان عفونتهای مزمن در دندانهای بدون پالپ موفقیتآمیز باشد، زیرا میزان دارویی که به کانالهای ریشه در چنین دندانهایی میرسد ناچیز است. تعداد کمی از عفونت های ریشه و ضایعات اطراف رادیکولار تحت تأثیر استفاده از آنتی بیوتیک درمانی سیستمیک قرار نمی گیرند. این مفهوم کاربرد دارویی موضعی مانند مسدود سازی ضایعه و ترمیم بافت توسط sustained release devices، شستشوی نهایی یا خمیرها را برای از بین بردن ضایعات ریشه و بهبود شرایط اطراف رادیکولار تکامل داد.
اکولوژی میکروبی مرتبط با عفونت های ریشه شامل هوازی اختیاری و همچنین اجباری و بی هوازی است. در مطالعه حاضر، متذکر شد که در بین تمامی عوامل آنتی باکتریال آزمایش شده، مترونیدازول کمترین حساسیت را در برابر تمامی باکتری ها از خود نشان داد. مترونیدازول در برابر تک سلولی ها و باکتری های بی هوازی موثر است، اما اگر دوز آن از نظر کمی یا کیفی تغییر کند، بسیار مستعد ایجاد مقاومت میکروبی به ویژه باکتری های بی هوازی است. در صورت استفاده همراه با پنی سیلین، همیشه نتایج خوبی برای مبارزه با عفونت های ریشه و ادنتوژنیک داشته است. این نتایج با یافته های قبلی مطابقت دارد. داکسی سایکلین، یک آنتی بیوتیک وسیع الطیف از گروه تتراسایکلین ها، هنگامی که به عنوان یک آنتی بیوتیک موضعی داخل کانالی و به عنوان یک شوینده نهایی ریشه استفاده می شود، بر روی طیف وسیعی از میکروارگانیسم های ریشه موثر است.
نتایج مطالعه حاضر نیز با یافته های قبلی مطابقت داشت و اثر قابل مقایسه داکسی سایکلین در شرایط آزمایشگاهی را در برابر بی هوازی های اختیاری و اجباری نشان داد. کلیندامایسین از سنتز پروتئین باکتریایی جلوگیری می کند و به سلول های باکتری بیش از سطح ترمیم ، آسیب می رساند.
مشاهده شده است که در غلظت های زیر بازدارنده، به کاهش تولید سم کمک می کند و اپسونیزاسیون و فاگوسیتوز سلول های میکروبی را افزایش می دهد. كليندامايسين بيشترين حساسيت را در برابر تقريباً تمام ایزوله هاي باكتريايي مورد استفاده در اين آزمايش نشان داد كه با مطالعات قبلي همخواني داشت.
با توجه به مکانیسم اثر هر یک از عوامل ضد باکتریایی، تصمیم گرفته شد که کلیندامایسین، مترونیدازول و داکسی سایکلین به ترتیب با نسبت 5:5:1 ترکیب شوند. این ترکیب اثر ضد باکتریایی خوبی را نشان داد که نشان دهنده پتانسیل حذف بالا و حداقل توسعه مقاومت آنتی بیوتیکی است.
دلیل چنین مشاهداتی برای این ترکیب را می توان به آسیب چند نقطه سلول باکتری، هدف قرار دادن دیواره سلولی باکتری، دستگاه میکروزومی، ریبوزوم، میتوکندری، RNA و چرخه سنتز پروتئین نسبت داد. همچنین، حداقل شانس زنده ماندن سلول های باکتریایی از چنین آسیب شدیدی وجود دارد. استفاده از این ترکیب ضد میکروبی در کانال های ریشه و بافت اطراف رادیکولار به عنوان یک شوینده ممکن است در ضد عفونی کردن سیستم ریشه موضعی موثر باشد. این امر به کاهش شکست درمان ریشه به دلیل عفونت توسط چنین باکتریایی کمک می کند. برای عوامل ضد میکروبی، فعالیت وابسته به غلظت، مانند CMD، ممکن است به عوامل ضد میکروبی وابسته به زمان ترجیح داده شود زیرا زمان تماس محدود است. بنابراین، فرضیه ترکیب کلیندامایسین، داکسیسایکلین و مترونیدازول که اثربخشی بهتری نسبت به عوامل فردی برای از بین بردن پاتوژنهای ریشه انتخاب شده نشان میدهد، اثبات شد.
محدودیت های مطالعه:
- به عنوان یک آزمایش آزمایشگاهی، مطالعه حاضر نمی تواند سناریوهای بالینی را بازتولید کند.
- با توجه به محدودیت های مالی، سویه های باکتریایی محدودی در این مطالعه مورد آزمایش قرار داده شدند.
- مواد آزمایشی مورد استفاده در این مطالعه با عوامل غیر آنتی بیوتیک استاندارد مقایسه نشدند.
نتیجه
در این مطالعه، ترکیب CMD بر روی گونههای باکتریایی منتخب مرتبط با عفونتهای ریشه مؤثر بود. بر اساس نتایج بهدستآمده، ترکیب حاضر را میتوان بهعنوان یک ابزار مؤثر برای کاربرد موضعی (مثلاً داروی داخل کانال ریشه) به جای یک عامل آنتیباکتریایی منفرد برای از بین بردن تمام اشکال باکتریایی رویشی و غیر رویشی توصیه کرد. همچنین می توان برای توسعه سیستم های دارورسانی مانند شستشو/خمیر داخل کانال یا ژل های رهش کنترل شده برای از بین بردن عفونت های ریشه کار کرد. با این حال، مطالعات بیشتری برای ارزیابی کاربردهای بالینی آن توصیه می شود.
منابع مقاله ارزیابی آزمایشگاهی ترکیبی جدید از سه خمیر آنتیبیوتیکی در برابر پاتوژنهای رایج ریشه
1. Casadevall A, Pirofski L. Host-pathogen interactions: the attributes of virulence. J Infect Dis. 2001 Aug;184(3):337-44.
2. Koo H, Allan RN, Howlin RP, Stoodley P, Hall-Stoodley L. Targeting microbial biofilms: current and prospective therapeutic strategies. Nat Rev Microbiol. 2017 Dec;15(12):740-55.
3. Gabrilska RA, Rumbaugh KP. Biofilm models of polymicrobial infection. Future Microbiol. 2015;10(12):1997-2015.
4. Peterson SN, Snesrud E, Liu J, Ong AC, Kilian M, Schork NJ, et al. The dental plaque microbiome in health and disease. PLoS One. 2013;8(3): e58487.
5. van Houte J, Lopman J, Kent R. The predominant cultivable flora of sound and carious human root surfaces. J Dent Res. 1994 Nov;73(11):1727-34.
6. Ghabraei S, Bolhari B, Sabbagh MM, Afshar MS. Comparison of Antimicrobial Effects of Triple Antibiotic Paste and Calcium Hydroxide Mixed with 2% Chlorhexidine as Intracanal Medicaments Against Enterococcus faecalis Biofilm. J Dent (Tehran). 2018 May;15(3):151- 60.
7. Gilad JZ, Teles R, Goodson M, White RR, Stashenko P. Development of a clindamycinimpregnated fiber as an intracanal medication in endodontic therapy. J Endod. 1999 Nov; 25(11):722-7.
8. Neelakantan P, Romero M, Vera J, Daood U, Khan AU, Yan A, et al. Biofilms in Endodontics-Current Status and Future Directions. Int J Mol Sci. 2017 Aug;18(8):1748.
9. Yoo YJ, Perinpanayagam H, Oh S, Kim AR, Han SH, Kum KY. Endodontic biofilms: contemporary and future treatment options. Restor Dent Endod. 2019 Jan 31;44(1):e7.
10. Panpaliya NP, Dahake PT, Kale YJ, Dadpe MV, Kendre SB, Siddiqi AG, et al. In vitro evaluation of antimicrobial property of silver nanoparticles and chlorhexidine against five different oral pathogenic bacteria. Saudi Dent J. 2019 Jan;31(1):76-83.
11. Qaiyumi S. Macro and microdilution methods of antimicrobial susceptibility testing. In: Schwabe R, Steele-Moore L, Goodwil AC. (Eds.), Antimicrobial Susceptibility Testing Protocols. CRC Press, United State of America. 2007: pp 75-9.
12. Espinel-Ingroff A, Colombo AL, Cordoba S, Dufresne PJ, Fuller J, Ghannoum M, et al. International Evaluation of MIC Distributions and Epidemiological Cutoff Value (ECV) Definitions for Fusarium Species Identified by Molecular Methods for the CLSI Broth Microdilution Method. Antimicrob Agents Chemother. 2015 Dec 7;60(2):1079-84.
13. Segura-Egea JJ, Gould K, Şen BH, Jonasson P, Cotti E, Mazzoni A, et al. Antibiotics in Endodontics: a review. Int Endod J. 2017 Dec; 50(12):1169-84.
14. Liljemark WF, Bloomquist C. Human oral microbial ecology and dental caries and periodontal diseases. Crit Rev Oral Biol Med. 1996;7(2):180-98.
15. Sundqvist G, Figdor D, Persson S, Sjögren U. Microbiologic analysis of teeth with failed endodontic treatment and the outcome of conservative re-treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998 Jan; 85(1): 86-93.
16. Radcliffe CE, Potouridou L, Qureshi R, Habahbeh N, Qualtrough A, Worthington H, et al. Antimicrobial activity of varying concentrations of sodium hypochlorite on the endodontic microorganisms Actinomyces israelii, A. naeslundii, Candida albicans and Enterococcus faecalis. Int Endod J. 2004 Jul; 37 (7):438-46.
17. Molander A, Reit C, Dahlén G, Kvist T. Microbiological status of root-filled teeth with apical periodontitis. Int Endod J. 1998 Jan;31 (1):1-7.
18. Nair PN, Sjögren U, Krey G, Kahnberg KE, Sundqvist G. Intraradicular bacteria and fungi in root-filled, asymptomatic human teeth with therapy-resistant periapical lesions: a long-term light and electron microscopic follow-up study. J Endod. 1990 Dec;16(12):580-8.
19. Yamane K, Ogawa K, Yoshida M, Hayashi H, Nakamura T, Yamanaka T, et al. Identification and characterization of clinically isolated biofilm-forming gram-positive rods from teeth associated with persistent apical periodontitis. J Endod. 2009 Mar;35(3):347-52.
20. Evans M, Davies JK, Sundqvist G, Figdor D.Mechanisms involved in the resistance of Enterococcus faecalis to calcium hydroxide. Int Endod J. 2002 Mar;35(3):221-8.
21. Pereira RS, Rodrigues VAA, Furtado WT, Gueiros S, Pereira GS, Avila-Campos MJ. Microbial analysis of root canal and periradicular lesion associated to teeth with endodontic failure. Anaerobe. 2017 Dec; 48:12-18.
22. Garcez AS, Ribeiro MS, Tegos GP, Núñez SC, Jorge AO, Hamblin MR. Antimicrobial photodynamic therapy combined with conventional endodontic treatment to eliminate root canal biofilm infection. Lasers Surg Med. 2007 Jan;39(1):59-66.
23. Nomura R, Ogaya Y, Nakano K. Contribution of the Collagen-Binding Proteins of Streptococcus mutans to Bacterial Colonization of Inflamed Dental Pulp. PLoS One. 2016 Jul 21;11(7):e0159613.
24. Del Fabbro M, Corbella S, Sequeira-Byron P, et al. Endodontic procedures for retreatment of periapical lesions. Cochrane Database Syst Rev. 2016;10(10):CD005511.
25. Mohammadi Z, Abbott PV. On the local applications of antibiotics and antibiotic-based agents in endodontics and dental traumatology. Int Endod J. 2009 Jul;42(7):555-67.
26. Sandor GK, Low DE, Judd PL, Davidson RJ. Antimicrobial treatment options in the management of odontogenic infections. J Can Dent Assoc. 1998 Jul-Aug;64(7):508-14.
27. Cvek M, Cleaton-Jones P, Austin J, Lownie J, Kling M, Fatti P. Effect of topical application of doxycycline on pulp revascularization and periodontal healing in reimplanted monkey incisors. Endod Dent Traumatol. 1990 Aug; 6 (4):170-6.
28. Torabinejad M, Khademi AA, Babagoli J, Cho Y, Johnson WB, Bozhilov K, et al. A new solution for the removal of the smear layer. J Endod. 2003 Mar;29(3):170-5.
29. Chan Y, Chan CH. Antibiotic resistance of pathogenic bacteria from odontogenic infections in Taiwan. J Microbiol Immunol Infect. 2003 Jun;36(2):105-10.
30. Smieja M. Current indications for the use of clindamycin: A critical review. Can J Infect Dis. 1998 Jan;9(1):22-8.
31. Behra-Miellet J, Dubreuil L, Jumas-Bilak E. Antianaerobic activity of moxifloxacin compared with that of ofloxacin, ciprofloxacin, clindamycin, metronidazole and beta-lactams. Int J Antimicrob Agents. 2002 Nov;20(5):366-74